31-03-2025 - Chemistry Basics - Chemical Kinetics (part 2) [EN]-[IT]
11 comments

~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH

31-03-2025 - Chemistry Basics - Chemical Kinetics (part 2) [EN]-[IT]
With this post I would like to give a brief instruction on the topic mentioned in the subject
(code notes: X_60)
Chemical Kinetics (part 2)

image created with artificial intelligence, the software used is Microsoft Copilot
Introduction
Chemical kinetics, which we also talked about in the previous article, is the subject that studies the speed of chemical reactions, that is, how long the reactions take. Chemical kinetics studies how much time elapses from when a chemical reaction starts to when it ends.
Factors that influence the rate of reactions are:
-Concentration of reagents
-Temperature
-Catalysts
-Contact surface
-Quality control
-Accident prevention
-Scientific research
-Environmental applications
-Improvement of energy technologies
Purpose of chemical kinetics
Chemical kinetics is a fundamental study in several sectors, below is a list of some fields of application.
-Optimization of industrial processes
-Development of new materials
Kinetic equations
Why are kinetic equations important?
Kinetic equations are important because they describe the relationship between reaction rate and concentration of reagents.
Kinetic laws
From experimental observations we know that the rates of chemical reactions depend on the concentrations of reagents.
To talk about this, let's consider the following chemical reaction in the gas phase in which nitrous oxide, N2O, decomposes to form molecular nitrogen and oxygen, here is the chemical expression:
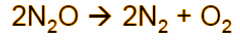
Example experiment
We carry out the experiment at a temperature of 1000 °C starting each time from different values of the initial concentration of N2O (see table) and measuring its concentration at different moments of time. We report everything in a graph. We obtain curves with a characteristic exponential trend that decays to zero in
a few seconds. After 10 seconds, in fact, the concentration of N2O is practically negligible. Let's take a look at the slope of each curve at the initial moment t=0. At this point we can observe that the higher the initial concentration, the higher the slope and, consequently, the speed.
What can we deduce from all this?
Now we can deduce that the initial decomposition speed depends on the concentration of N2O.
half-life
Who is what?
The half-life (t½) is the time interval that must pass for the concentration of the starting reagent to be reduced by 50% compared to the initial value.
The half-life is a direct measure of the speed of a chemical reaction.
The half-life is also called half-life.
This period of time is important when we enter the study of drugs. Determining the duration of the effect of a drug in the body is extremely important and therefore knowing the effects that can be had during the half-life is also important.
Furthermore, the half-life is also important when we enter the field of study on radioactivity and environmental chemistry.
Finally, studying the half-life helps to better understand the reaction mechanisms and to determine whether a reaction follows first-order kinetics or other types.
First-order chemical kinetics
First-order chemical kinetics concerns reactions in which the reaction rate is directly proportional to the concentration of a single reagent. Technically we can say that a first-order reaction has a rate that depends linearly on the concentration of a reagent.
Temperature Effect and Svante Arrhenius

image created with artificial intelligence, the software used is Microsoft Copilot
In the previous article I talked about the effect of the browning of a cut apple. We talked about the concept that the speed of browning depends on the temperature at which the test is carried out.
We can say that, in general, an increase in temperature causes an increase in the reaction speed. The effect of temperature was studied for the first time by the Swedish chemist Svante Arrhenius who observed that by reporting the natural logarithm of the kinetic constant as a function of the inverse of the temperature, the experimental data fell on a straight line. In practice, by performing the same kinetic experiment at different temperatures and measuring the kinetic constant k, the relationship between ln k and 1/T was practically linear.
Below is the mathematical expression that encompasses the concept of Svante Arrhenius.
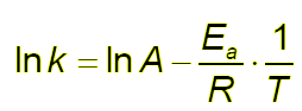
Svante Arrhenius (born 1859 - died 1927) was a Swedish scientist, known for his fundamental contributions to physical chemistry and climatology. His studies on climatology were very important, in the question at the bottom of the article you will find a nice curiosity.
The collision theory
image created with artificial intelligence, the software used is Microsoft Copilot
When we talk about chemical kinetics we must consider that there is also the interpretation of the reaction rate through the collision theory and we can say the following.
Let's consider the chemical reaction between two species in the gaseous phase A and B. The speed with which the reaction products are formed depends on the number of collisions per unit of time (collision frequency) that occur between the molecules of A and the molecules of B. The higher the collision frequency, the more likely it is that the reaction will occur, that is, that the reactants will convert into products. Intuitively, we expect the collision frequency to be proportional to the concentration of A and B. The greater the number of A molecules per unit volume, the higher the probability that collisions with B molecules will occur. The same is true for B. Mathematically, we could translate what is written in the following mathematical form:
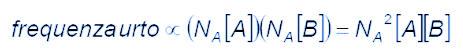
Conclusions
Collision theory is used to optimize chemical reactions in the drug production sector and in the synthesis of new materials. Collision theory helps improve efficiency and reduces costs. It must be reiterated that collision theory, in chemistry, is still developing and today it is also very useful for solving environmental and energy problems.
Question
Did you know that Svante Arrhenius calculated how changes in the concentration of carbon dioxide in the atmosphere can affect the temperature of the Earth? Did you know that Arrhenius was one of the first scientists to study the greenhouse effect?

ITALIAN

31-03-2025 - Basi di chimica - Cinetica chimica (parte 2) [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_60)
Cinetica chimica (parte 2)

immagine creata con l’intelligenza artificiale, il software usato è Microsoft Copilot
Introduzione
La cinetica chimica, di cui ne abbiamo parlato anche nell'articolo precedente, è la materia che studia la velocità delle reazioni chimiche, cioè in quanto tempo le reazioni avvengano. La cinetica chimica studia quanto tempo intercorre da quando una reazione chimica inizia a quando finisce.
I fattori che influenzano la velocità delle reazioni sono:
-Concentrazione dei reagenti
-Temperatura
-Catalizzatori
-Superficie di contatto
-Controllo della qualità
-Prevenzione di incidenti
-Ricerca scientifica
-Applicazioni ambientali
-Miglioramento delle tecnologie energetiche
Scopo della cinetica chimica
La cinetica chimica è uno studio fondamentale in diversi settori, qui di seguito un elenco di alcuni campi di applicazione.
-Ottimizzazione dei processi industriali
-Sviluppo di nuovi materiali
Equazioni cinetiche
Perché sono importanti le equazioni cinetiche?
Le equazioni cinetiche sono importanti perché descrivono la relazione tra velocità di reazione e la concentrazione di reagenti.
Leggi cinetiche
Dalle osservazioni sperimentali sappiamo che le velocità delle reazioni chimiche dipendono dalle concentrazioni dei reagenti.
Per parlare della cosa consideriamo la seguente reazione chimica in fase gas in cui il protossido di azoto, N2O, si decompone a formare azoto e ossigeno molecolari, qui di seguito l'espressione chimica:
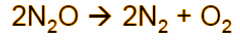
Esperimento di esempio
Effettuiamo l’esperimento alla temperatura di 1000 °C partendo di volta in volta da diversi valori della concentrazione iniziale di N2O (vedi tabella) e misurando la sua concentrazione a diversi istanti
di tempo. Riportiamo tutto in un grafico. Si ottengono delle curve con un caratteristico andamento esponenziale che decade a zero in
pochi secondi. Dopo 10 secondi infatti la concentrazione di N2O è praticamente trascurabile. Buttiamo un occhio alla pendenza di ciascuna curva all’istante iniziale t=0. A questo punto possiamo osservare che maggiore è la concentrazione iniziale e più alta è la pendenza e, di conseguenza, la velocità.
Cosa possiamo dedurre da tutto questo?
Adesso possiamo dedurre che la velocità di decomposizione iniziale dipende dalla concentrazione di N2O.
tempo di dimezzamento
Chi cosa é?
Il tempo di dimezzamento (t½) è l’intervallo temporale che deve trascorrere affinché la concentrazione del reagente di partenza si riduca del 50% rispetto al valore iniziale.
Il tempo di dimezzamento è una misura diretta della velocità di una reazione chimica.
Il tempo di dimezzamento è chiamato anche emivita.
Questo lasso di tempo è importante quando entriamo nello studio dei farmaci. Determinare la durata dell'effetto di un farmaco nel corpo è estremamente importante e quindi anche sapere gli effetti che si possono avere durante il tempo di dimezzamento è importante.
Inoltre il tempo di dimezzamento è importante anche quando entriamo nel campo degli studio sulla radioattività e nella chimica ambientale.
Infine studiare il tempo di dimezzamento aiuta a comprendere meglio i meccanismi di reazione e a determinare se una reazione segue una cinetica di primo ordine o di altro tipo.
Cinetica chimica di primo ordine
La cinetica chimica di primo ordine riguarda le reazioni in cui la velocità di reazione è direttamente proporzionale alla concentrazione di un singolo reagente. tecnicamente possiamo dire che una reazione di primo ordine ha una velocità che dipende linearmente dalla concentrazione di un reagente.
Effetto della temperatura e Svante Arrhenius

immagine creata con l’intelligenza artificiale, il software usato è Microsoft Copilot
Nell'articolo precedente avevo parlato dell'effetto dell'imbrunimento di una mela tagliata. Abbiamo parlato del concetto che la velocità di imbrunimento dipende dalla temperatura a cui si effettua la prova.
Possiamo dire che, in generale, un aumento della temperatura causa un incremento della velocità di reazione. L’effetto della temperatura fu studiato per la prima volta dal chimico svedese Svante Arrhenius il quale osservò che riportando il logaritmo naturale della costante cinetica in funzione dell’inverso della temperatura, i dati sperimentali si collocavano su una linea retta. In pratica, effettuando lo stesso esperimento di cinetica a temperature diverse e misurando la costante cinetica k, la relazione tra ln k e 1/T era praticamente lineare.
Qui di seguito l'espressione matematica che racchiude il concetto di Svante Arrhenius.
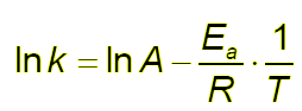
Svante Arrhenius (mato il 1859- deceduto il1927) è stato uno scienziato svedese, noto per i suoi contributi fondamentali alla chimica fisica e alla climatologia. I suoi studi sulla climatologia furono importantissimi, nella domanda in fondo all'articolo troverete una bella curiosità.
La teoria delle collisioni

immagine creata con l’intelligenza artificiale, il software usato è Microsoft Copilot
Quando parliamo di cinetica chimica dobbiamo pensare che esiste anche l'interpretazione della velocità di reazione mediante la teoria delle collisioni e possiamo dire quanto segue.
Consideriamo la reazione chimica tra due specie in fase gassosa A e B. La velocità con cui si formano i prodotti di reazione dipende dal numero di urti per unità di tempo (frequenza degli urti) che avvengono tra le molecole di A e le molecole di B. Maggiore è la frequenza d’urto più è probabile che la reazione avvenga, ovvero che i reagenti si convertano in prodotti. Intuitivamente ci si aspetta che la frequenza d’urto sia proporzionale alla concentrazione di A e di B. Maggiore è il numero di molecole di A per unità di volume è più alta sarà la probabilità che avvengano degli urti con le molecole di B. Lo stesso vale per B. Matematicamente potremmo tradurre quanto scritto nella seguente forma matematica:
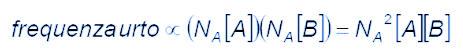
Conclusioni
La teoria delle collisioni è utilizzata per ottimizzare reazioni chimiche nel settore della produzione di farmaci e nella sintesi di nuovi materiali. La teoria delle collisioni aiuta a migliorare l'efficienza e riduce i costi. Bisogna assolutamente ribadire che la teoria delle collisioni, in chimica, si sta ancora sviluppando ed oggi è molto utile anche per la risoluzione di problemi ambientali ed energetici.
Domanda
Lo sapevate che Svante Arrhenius aveva calcolato come le variazioni nella concentrazione di anidride carbonica nell'atmosfera possono influenzare la temperatura della Terra? Lo sapevate che Arrhenius è stato uno dei primi scienziati a studiare l'effetto serra?
THE END




Comments