29-03-2025 - Chemistry Basics - Solutions - part 2 [EN]-[IT]
9 comments

~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH

28-03-2025 - Chemistry Basics - Solutions - part 2 [EN]-[IT]
With this post I would like to give a short instruction about the topic mentioned in the subject
(code notes: X_62)
Solutions - part 2
this image was created with artificial intelligence, software used Microsoft Copilot
Solubility of gases in liquids
When we talk about the solubility of gases in liquids we must think of Henry's law.
Henry's law states that the solubility of a gas in a liquid is directly proportional to the partial pressure of the gas.
Below is the mathematical expression of this law.
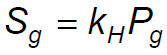
Where:
Sg = solubility of the gas
Kh = Henry's constant
Pg = partial pressure of the gas
In this relationship the solubility of the gas (Sg) is expressed in moles of dissolved gas per kg of solution (since the density of the liquid containing the dissolved gas is not different from the density of the pure liquid, we can also say "moles of dissolved gas per kg of solvent").
The partial pressure of the gas has been indicated with Pg (atm or in bar) while the constant kH, called Henry's constant, represents the proportionality factor between Sg and Pg. Henry's constant has the dimensions of mol L-1 atm-1 (or mol L-1 bar-1 if the pressure is expressed in bar).
Examples
-A carbonated drink is an example of gas (CO2) dissolved in a liquid (water).
-Blood contains dissolved gas, oxygen, which is used by cells, and nitrogen which is inert.
Solubilization and entropy

this image was created with artificial intelligence, software used Microsoft Copilot
The solubilization of a gas in a liquid is generally an exothermic process (ΔH<0) accompanied by a decrease in
entropy (a liquid is a more ordered system than a gas). Therefore the process is to be considered spontaneous only at low temperatures.
Now we can say that Henry's constant, kH, like any equilibrium constant is linked to ΔG° through the relationship:
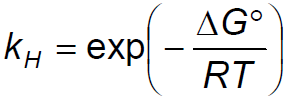
In this expression we find the term ΔG. We talked about it in some articles ago.
In the chemical field when we find the term ΔG we are faced with something that represents the variation of the Gibbs free energy during a chemical reaction.
Liquid-vapor equilibrium

this image was created with artificial intelligence, software used Microsoft Copilot
Liquid-vapor equilibrium of liquid mixtures is a condition in which the liquid and vapor phases of a mixture are in thermodynamic equilibrium. This means that the evaporation rate of the liquid is equal to the condensation rate of the vapor, creating a dynamic equilibrium.
One of the key points of this concept is Raoult's law.
Solutions that satisfy Rault's law (1 or 2) are called ideal.
In an ideal solution, at L-V equilibrium, the partial pressure (PJ) in the gas phase of the generic species J is a fraction (via XJ) of its vapor pressure P°J. The study of L-V equilibrium processes of liquid mixtures is of enormous importance in the chemical industry. Suffice it to say that petroleum distillation operations are based on L-V equilibria of liquid mixtures with complex compositions that vary from reservoir to reservoir.
Relative volatility
In the chemical field, the concept of relative volatility is used to describe the ease with which two components of a liquid mixture can be separated by distillation.
high relative volatility = the components can be separated more easily
relative volatility close to 1 = the separation will be more difficult and may require more distillation trays or other advanced separation techniques.
Osmotic pressure
The phenomenon of osmosis occurs when two solutions (for example aqueous) with different concentrations of solute are separated by a semipermeable membrane that allows only the solvent molecules to pass.
Osmotic pressure is the pressure needed to prevent osmosis, which, in different words than those described above, is the movement of the solvent through a semipermeable membrane towards a more concentrated solution.
Example of use of osmosis
A technology for purifying water is based on reverse osmosis. If a pressure significantly higher than the osmotic pressure is applied to the aqueous solution containing the salts, the water molecules are forced to pass through the semipermeable membrane. In this way, you get pure water on one side and a very concentrated aqueous solution of salts on the other.
Conclusions
Chemical solutions and osmosis are interconnected through the concentration of solute particles and the movement of the solvent to reach equilibrium. This phenomenon is important in both biological and industrial fields.
Question
Liquid-vapor equilibrium in chemistry is a condition in which the liquid and vapor phases of a substance or mixture are in thermodynamic equilibrium and is the subject of many studies in the chemical field.
Did you know that petroleum distillation operations are based on Liquid - Vapor equilibria?

ITALIAN

28-03-2025 - Basi di chimica - Soluzioni - parte 2 [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_62)
Soluzioni - parte 2

questa immagine è stata creata con l'intelligenza artificiale, software usato Microsoft Copilot
Solubilità dei gas nei liquidi
Quando parliamo di solubilità dei gas nei liquidi dobbiamo pensare alla legge di Henry.
La legge di Henry stabilisce che la solubilità di un gas in un liquido è direttamente proporzionale alla pressione parziale del gas.
Qui di seguito l'espressione matematica di tale legge.
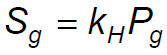
Dove:
Sg = solubilità del gas
Kh = costante di Henry
Pg = pressione parziale del gas
In questa relazione la solubilità del gas (Sg) è espressa in moli di gas disciolto per kg di soluzione (poiché la densità del liquido contenente il gas disciolto non è diversa dalla densità del liquido puro si può dire anche «moli di gas disciolto per kg di solvente»).
La pressione parziale del gas è stata indicata con Pg (atm oppure in bar) mentre la costante kH, detta costante di Henry, rappresenta il fattore di proporzionalità tra Sg e Pg. La costante di Henry ha le dimensioni di mol L-1 atm-1 (oppure mol L-1 bar-1 se la pressione viene espressa in bar).
Esempi
-Una bibita gassata è un esempio di gas (CO2) disciolta in un liquido (acqua).
-Il sangue contiene del gas disciolto, ossigeno, che viene utilizzato dalle cellule, e azoto che invece è inerte.
Solubilizzazione ed entropia

questa immagine è stata creata con l'intelligenza artificiale, software usato Microsoft Copilot
La solubilizzazione di un gas in un liquido è generalmente un processo esotermico (ΔH<0) accompagnato da una diminuzione di
entropia (un liquido è un sistema più ordinato di un gas). Quindi il processo è da considerarsi spontaneo solo a bassa temperatura.
Ora possiamo dire che la costante di Henry, kH, al pari di ogni costante di equilibrio è legata al ΔG° tramite la relazione:
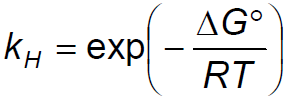
In questa espressione ritroviamo il temine ΔG. Ne avevamo parlato in qualche articolo fa.
In ambito chimico quando troviamo il termine ΔG siamo davanti a qualcosa che rappresenta la variazione dell'energia libera di Gibbs durante una reazione chimica.
Equilibrio liquido vapore

questa immagine è stata creata con l'intelligenza artificiale, software usato Microsoft Copilot
L'equilibrio liquido-vapore di miscele liquide è una condizione in cui le fasi liquida e vapore di una miscela sono in equilibrio termodinamico. Questo vuol dire che la velocità di evaporazione del liquido è uguale alla velocità di condensazione del vapore, creando un equilibrio dinamico.
Uno dei punti chiave di questo concetto è la legge di Raoult.
Le soluzioni che soddisfano la legge di Rault (1 oppure 2) si definiscono ideali.
In una soluzione ideale, all’equilibrio L-V, la pressione parziale (PJ) in fase gas della specie generica J è una frazione (tramite XJ) della sua tensione di vapore P°J. Lo studio dei processi di equilibrio L-V di miscele liquide ha un’importanza enorme nell’industria chimica. Basti pensare che le operazioni di distillazione del petrolio sono basate su equilibri L-V di miscele liquide aventi composizione complessa e variabile da giacimento a giacimento.
Volatilità relativa
In ambito chimico il concetto di volatilità relativa viene usato per descrivere la facilità con cui due componenti di una miscela liquida possono essere separati tramite distillazione.
volatilità relativa alta = i componenti possono essere separati più facilmente
volatilità relativa vicina a 1 = la separazione sarà più difficile e potrebbe richiedere più piatti di distillazione o altre tecniche di separazione avanzate.
Pressione osmotica
Il fenomeno dell’osmosi si verifica quando due soluzioni (ad esempio acquose) a concentrazioni diverse di soluto sono separate da una membrana semipermeabile che lascia passare solo le molecole di solvente.
La pressione osmotica è la pressione necessaria per impedire l'osmosi, che, in parole diverse da quelle descritte sopra, è il movimento del solvente attraverso una membrana semipermeabile verso una soluzione più concentrata.
Esempio di utilizzo dell'osmosi
Una tecnologia per purificare l’acqua è quella basata sull’osmosi inversa. Se si applica una pressione nettamente superiore alla pressione osmotica sulla soluzione acquosa contenente i sali, le molecole d’acqua sono costrette a passare attraverso la membrana semipermeabile. In questo modo si ottiene acqua pura da un lato e una soluzione acquosa molto concentrata di sali dall’altro.
Conclusioni
Le soluzioni chimiche e l'osmosi sono interconnesse attraverso la concentrazione delle particelle di soluto e il movimento del solvente per raggiungere l'equilibrio. Questo fenomeno è importante sia in ambito biologico che industriale.
Domanda
L'equilibrio liquido-vapore in chimica è una condizione in cui le fasi liquida e vapore di una sostanza o di una miscela sono in equilibrio termodinamico ed è oggetto di moltissimi studi in ambito chimico.
Lo sapevate che le operazioni di distillazione del petrolio sono basate su equilibri Liquidi - Vapore?
THE END

Comments